Diagram Fase Pada Materi Sifat Koligatif Larutan
A. Pengertian Sifat Koligatif Larutan
Jejaring Kimia - Sifat-sifat larutan, seperti halnya rasa, bau, dan warna bergantung pada jenis zat terlarut. Larutan gula mempunyai rasa manis, beda halnya dengan larutan cuka yang memiliki rasa asam. Tingkat kemanisan maupun keasaman kedua larutan tersebut tergantung pada konsentrasi atau kepekatannya. Larutan gula maupun cuka yang pekat tentu akan memiliki tingkat kemanisan dan keasaman yang lebih tinggi jika dibanding dengan larutan gula maupun cuka yang memiliki kepekatan rendah.
Selain sifat yang pada jenis zat terlarut, ada beberapa sifat larutan yang hanya tergantung pada konsentrasi partikel zat terlarut. Artinya larutan yang berbeda akan mempunyai sifat sifat yang sama, dengan syarat konsentrasi partikel zat terlarutnya harus sama. Contoh 0,5 mol glukosa akan mempunyai sifat yang sama dengan 0,5 mol urea (jumlah kedua partikel zat terlarut yaitu glukosa dan urea besarnya sama). Sifat yang hanya tergantung pada jumlah partikel zat terlarut disebut sifat koligatif larutan. Ada empat sifat koligatif larutan yaitu, penurunan tekanan uap, penurunan titik beku, kenaikan titik didih, dan tekanan osmosis. Salah satu aplikasi sifat koligatif larutan adalah pembuatan es krim di mana harus di turunkan di bawah titik beku pelarut H2O yaitu 0oC dengan penambahan partikel zat terlarut seperti garam. Semakin banyak garam yang ditambahkan ke dalam pelarut, maka titik beku akan semakin rendah.
Baca juga, Perbedaan Sifat Larutan Hipotonik, Isotonik, dan Hipertonik
B. Diagram Fase atau Diagram P - T pada Pelarut H2O
Mengapa larutan (pelarut + zat terlarut) mendidih pada suhu yang lebih tinggi dan membeku pada suhu yang lebih rendah dari pada pelarutnya? Pertanyaan ini dapat dijelaskan secara teoritis dengan membandingkan diagram fase pelarut dengan diagram fase larutannya.
Klik untuk memperjelas gambar
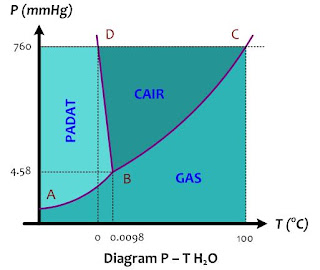
Diagram fase atau biasa disebut juga diagram P - T adalah diagram yang menyatakan hubungan antara suhu (T) dan tekanan P dengan fase zat (padat, cair, dan gas). Diagram fase menyatakan batas-batas suhu dan tekanan di mana suatu bentuk fase dapat stabil. Diagram fase H2O dapat dilihat pada gambar di bawah ini.
Baca juga, Membandingkan Titik Didih Larutan NaCl dan Air
Berikut penjelasan diagram P - T dengan pelarut H2O:
1. Garis didih
Garis B - C pada gambar di atas disebut garis didih. Garis didih merupakan transisi fase cair - gas. Setiap titik pada garis ini menyatakan suhu dan tekanan di mana air akan mendidih. Seperti yang kita ketahui bahwa titik didih tergantung pada tekanan gas di permukaan. Pada tekanan 1 atm atau 760 mmHg, air mendidih pada suhu 100oC. Jika terdapat tempat di bumi ini yang mempunyai tekanan 4,58 mmHg, maka sudah dipastikan air akan mendidih pada kisaran 0,0098oC.
2. Garis beku
Garis B - D pada gambar di atas disebut garis beku. Garis beku merupakan transisi fase cair - padat. Setiap titik pada garis ini menyatakan suhu dan tekanan di mana air dapat membeku (es mencair). Pada tekanan 1 atm atau 760 mmHg, air membeku pada suhu 0oC, dan jika terdapat tempat di bumi ini yang mempunyai tekanan 4,58 mmHg, maka sudah dipastikan air akan membeku pada kisaran 0,0098oC. titik beku dan titik didih pada tekanan 4,58 mmHg mempunyai nilai yang sama, artinya titik didh = titik beku pelarut. Perhatikan bahwa tekanan permukaan berpengaruh besar pada titik didih, tetapi sangat kecil pengaruhnya terhadap titik beku. Garis B - D nyaris vertical terhadap sumbu suhu.
3. Garis sublimasi
Garis A - B pada diagram fase di atas disebut garis sublimasi. Garis sublimasi merupakan transisi fase pada gas. Setiap titik pada pada garis sublimasi menyatakan suhu dan tekanan di mana zat padat dan uapnya dapat menyublim.
4. Titik trpel
Perpotongan antara garis didih dengan garis beku dan garis sublimasi disebut titik tripel. Titik tripel air adalah 0,0098oC pada tekanan 4,58 mmHg. Pada titik tripelnya, ketiga bentuk fase, yaitu padat, cair, dan gas berada dalam kesetimbangan.
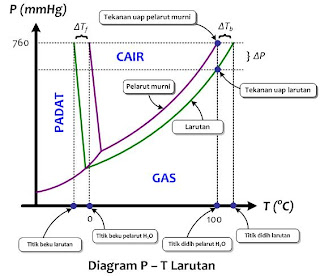
C. Diagram Fase atau Diagram P - T pada Larutan
Mari kita bandingkan dengan diagram fase larutan dengan diagram fase pelarutnya yaitu H2O, seperti tampak pada diagram P - T larutan berikut.
Klik untuk memperjelas gambar
Larutan mempunyai tekanan uap lebih rendah dari pada pelarut murninya (dalam hal ini air) yang dinyatakan sebagai. Oleh karena itu garis didih dan garis beku larutan berada di bawah garis didih dan garis beku pelarutnya. Penurunan tekanan uap tersebut berpengaruh terhadap titik didih dan titik beku larutan. seperti yang tampak pada diagram P - T larutan di atas, tekanan uap larutan belum 760 mmHg pada suhu 100oC. oleh karena itu belum mendidih. Larutan akan mendidih pada suhu di atas 100oC yaitu ketika tekanan uapnya mencapai 760 mmHg. Dengan kata lain, larutan mempunyai titik didih lebih tinggi dari pada pelarutnya. Sebaliknya, penurunan tekanan uap menyebabkan titik beku larutan lebih rendah dibandingkan dengan titik beku pelarutnya.


Komentar
Posting Komentar