Reaksi-reaksi Senyawa Karbon
Di sini akan dijelaskan secara ringkas berbagai macam reaksi senyawa karbon yaitu reaksi substitusi, reaksi eliminasi, reaksi adisi, reaksi polimerisasi, dan reaksi oksidasi.
Berikut penjelasan untuk masing-masing reaksi.
Contoh reaksi substitusi:
Berikut penjelasan untuk masing-masing reaksi.
1. Reaksi substitusi
Reaksi substitusi merupakan reaksi yang melibatkan penggantian atom / gugus atom pada molekul dengan atom/gugus atom lainnya. Reaksi substitusi umumnya terjadi pada senyawa jenuh (tunggal) tanpa terjadi perubahan ikatan karakteristik (tetap jenuh). Suatu reaksi subtitusi terjadi bila sebuah atom atau gugus yang berasal dari pereaksi menggantikan sebuah atom atau gugus dari molekul yang bereaksi. Subtitusi dapat terjadi pada karbon jenuh maupun tidak jenuh.R – X + R’ – Y ---> R – Y + R’ – X
Atom karbon ujung suatu alkil halida mempunyai muatan positif parsial. Karbon ini bisa mudah diserang oleh anion dan spesi lain yang mempunyai sepasang elektron menyendiri (unshared) dalam kulit luarnya. Dihasilkan reaksi subtitusi ion atau gugus disubstitusikan untuk (menggantikan) atom, atau gugus lain. Beberapa reaksi substitusi pada senyawa karbon: - Reaksi pembentukan haloalkana
- Reaksi alkil halida dengan basa kuat
- Reaksi alkohol dengan PCl3
- Reaksi alkohol dengan logam Natrium
- Reaksi klorinasi
- Reaksi esterifikasi (pembentukan ester)
- Reaksi saponifikasi (penyabunan)
Reaksi pembentukan haloalkana: reaksi alkana dengan halogen
R - H + X2 --> R - X + H - X
Contoh: CH3 - H + Cl2 --> CH3 - Cl + HCl Reaksi alkil halida dengan basa kuat
Contoh reaksi antara basa kuat dengan etil bromidaHO- + CH3CH2 – Br ---> CH3CH2 – OH + Br-
Dalam suatu reaksi substitusi alkil halida, halida itu disebut gugus pergi (leaving group) suatu istilah yang berarti gugus apa saja yang dapat digeser dari ikatannya dengan suatu atom karbon. Ion Halida merupakan gugus pergi yang baik, karena ion-ion ini merupakan basa yang sangat lemah. Basa kuat seperti misalnya OH- , bukan gugus pergi yang baik. Spesi (spesies) yang menyerang suatu alkil halida dalam suatu reaksi substitusi disebut nukleofil (nucleophile, “pecinta nukleus”), sering dilambangkan dengan Nu- . Dalam persamaan reaksi diatas, OH- adalah nukleofil. Umumnya, sebuah nukleofil ialah spesi apa saja yang tertarik ke suatu pusat positif; jadi sebuah nukleofil adalah suatu basa Lewis. Kebanyakan nukleofil adalah anion, namun beberapa molekul polar yang netral, seperti H2O, CH3OH dan CH3NH2 dapat juga bertindak sebagai nukleofil. Molekul netral ini memiliki pasangan elektron menyendiri, yang dapat digunakan untuk membentuk ikatan sigma. Reaksi substitusi atom H pada alkohol dengan logam reaktif (Na, K)
atom H pada gugus - OH dapat disubstitusi oleh logam reaktif seperti Na dan KR - OH + Na --> R - ONa + H2
Contoh: 2 C2H5 - OH + 2 Na --> 2 C2H5 - ONa + H2 Reaksi alkoksi alkana (eter) dengan PCl5 menghasilkan haloalkana
R - O - R’ + PCl5 --> R - Cl + R’ - Cl + POCl3
Contoh: CH3 - O - CH3 + PCl5 --> CH3Cl + CH3Cl +POCl3 Reaksi esterifikasi: reaksi pembentukan ester dari alkohol dan asam karboksilat
R - OH + R’ - COOH --> R’ - COOR + H - OH
Contoh CH3 - OH + CH3 - COOH --> CH3 - COOCH3 + H2O 2. Reaksi adisi
Reaksi adisi adalah reaksi senyawa karbon yang melibatkan penggabungan molekul-molekul. Reaksi adisi juga dapat diartikan sebagai reaksi pemutusan ikatan rangkap (tak jenuh) menjadi ikatan tunggal (jenuh). Reaksi adisi ini terjadi pada senyawa tidak jenuh (mempunyai ikatan rangkap). Molekol tidak jenuh dapat menerima tambahan atom atau gugus dari pereaksi tanpa melebihi angka koordinasi maksimum dari atomnya sendiri. Ikatan rangkap dua dan rangkap tiga karbon-karbon dan rangkap dua karbon-oksigen merupakan jenis struktur yang paling umum yang mengalami reaksi adisi.Contoh reaksi substitusi:
Reaksi adisi alkena dengan halogen
Reaksi adisi dengan brom digunakan untuk membedakan senyawa alkena (C = C) dengan siklo alkana. Hal ini karena kedua senyawa mempunyai isomer fungsional (rumus molekul sama, tetapi gugus fungsi berbeda). Pengamatan reaksinya dengan membedakan warna dari brom yaitu merah coklat. Alkena dapat bereaksi dengan brom sehingga warna merah coklat dari brom hilang menjadi tidak berwarna. Akan tetapi, sikloalkana tidak bereaksi dan warna merah coklat dari brom tetap. Alkena + brom ---> bereaksi, warna merah coklat dari brom hilangSikloalkana + brom ↛ tidak bereaksi, warna merah coklat dari brom tetap.Reaksi adisi alkena dengan senyawa asam halida (H - X)
Dalam adisi ini atom X terikat pada C rangkap dikiri atau dikanan akan menghasilkan senyawa yang berbeda, kecuali kalau R dengan R’ sama. Untuk itu, ada aturan yang menetapkan hasil utama dari reaksi adisi tersebut yang dikemukankan oleh Vlademir Markovnikov. Aturan Markovnikov :- ikatan rangkap merupakan kumpulan elektron
- gugus alkil merupakan gugus pendorong elektron. Alkil makin besar, daya dorong makin kuat. Urutan kekuatan alkil : - CH3, - C2H5, - C3H7
- gugus elektrongatif merupakan gugus penarik elektron. Makin elektronegatif, daya tarik elektron makin kuat.
Adisi Elektrofil gugus penyerang berupa pereaksi elektrofil.
Contoh : AB + C = C ---> A – C – C – B H2 + CH2 = CH2 ---> CH3 – CH3
Contoh : AB + C = C ---> A – C – C – B H2 + CH2 = CH2 ---> CH3 – CH3
Adisi Radikal Bebas gugus penyerang merupakan radikal bebas.
Contoh : CH4 + Cl. ---> CH3 + HCl
Contoh reaksi oksidasi:
Keterangan:
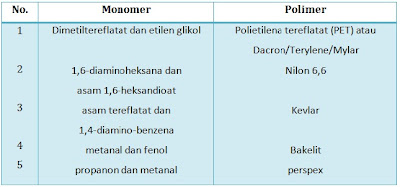
PET : suatu poliester yang secara teoritis dapat dibuat dari pencampuran asam flatat (asam karboksilat) dan etilen glikol (alkohol).
Nilon 6,6 : merupakan poliamida dengan gugus - CON - yang terbentuk dari polimerisasi 1,6-diaminoheksana dan asam 1,6-heksadioat.
Bakelit : polimer yang terbentuk dari polimerisasi metanal dan fenol.
Perspex : secara teoritis perspex terbentuk dari polimerisasi propanon (keton) dan metanal (aldehid) Download materinya, klik aja di sini
Contoh : CH4 + Cl. ---> CH3 + HCl
Reaksi adisi H2 pada alkena membentuk alkana
C2H5 - CH = CH - CH3 + H2 ---> C2H5 - CH2 - CH2 - CH3Reaksi hidrogenasi ini digunakan untuk membuat margarin (mentega tiruan) dari minyak yang mengandung asam lemak tak jenuh (C = C). Minyak cair dihidrogenasi dengan bantuan katalis Ni menghasilkan lemak padat.Reaksi adisi H2 pada alkanal membentuk alkohol primer
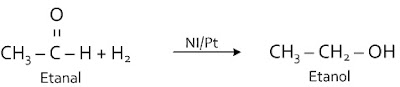
Ikatan rangkap C = O pada alkanal bereaksi dengan H2 untuk menghasilkan alkohol primer.Disebut juga dengan reaksi reduksi karena terjadi penurunan bilangan oksidasi C.
Reaksi adisi H2 pada keton/alkanon menghasilkan alkohol sekunder
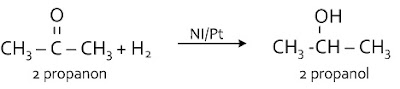
Ikatan rangkap C = O pada alkanon/keton bereaksi dengan H2 untuk menghasilkan alkohol sekunder.Reduksi H2O pada asam karboksilat menghasilkan suatu alkohol sekunder
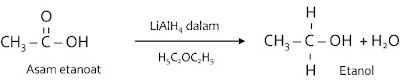
Ikatan rangkap C = O pada asam karboksilat akan terbuka akibat penambahan reduktor kuat untuk menghasilkan alkohol primer3. Reaksi eliminasi
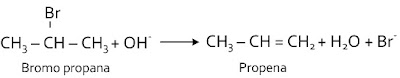
Reaksi eliminasi merupakan reaksi peruraian suatu molekul menjadi molekul-molekul lain di mana salah satu molekul dikatakan tereliminasi. Reaksi eliminiasi dapat juga dikatakan sebagai reaksi pembentukan ikatan rangkap dari ikatan tunggal (kebalikan dari reaksi adisi). Beberapa atom dipisahkan dari sebuah molekol untuk membentuk ikatan ganda atau siklis. Kebanyakan reaksi eliminasi menyangkut kehilangan atom bukan karbon. Reaksi penggantian ikatan berubah dari ikatan tunggal menjadi ikatan rangkap. Pada reaksi ini molekul senyawa yang berikatan tunggal (ikatan jenuh) berubah menjadi senyawa berikatan rangkap (ikatan tak jenuh) dengan melepaskan molekul yang kecil.Reaksi eliminasi H2 dari alkana menjadi alkena
CH3 - CH2 - CH3 --> CH3 - CH = CH2 + H2Reaksi eliminasi air (dehidrogenasi) dari alkohol
Alkohol dapat bereaksi membentuk alkena dengan bantuan katalis H2SO4 pekat berlebih pada suhu 180oC. CH3 - CH2 - OH --> CH2 = CH2 + H2OReaksi eliminasi HX dari haloalkana (dehidrohalogenasi)
Haloalkana R - X dapat bereaksi dengan gugus - OH yang larut dalam alkohol seperti NaOH etanolis atau CH3OK, membentuk alkuna.4. Reaksi oksidasi
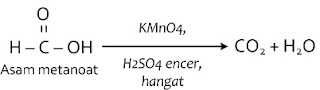
Reaksi melibatkan oksidator seperti O2, O3, dan KMnO4. Reaksi oksidasi yang penting adalah reaksi dengan O2 yang dikenal sebagai pembakaran.Contoh reaksi oksidasi:
Reaksi oksidasi alkohol primer, sekunder, dan tersier
Alkohol primer, sekunder, dan tersier memberikan reaksi berbeda terhadap oksidator seperti K2Cr2O7, KMnO4, dan O2.Reaksi oksidasi alkohol primer, sekunder, dan tersier selengkapnya dapat di lihat di sini.
Reaksi oksidasi pada alkoksi alkana (eter)
Alkoksi alkana bereaksi dengan O2 membentuk senyawa hidroperoksidaReaksi oksidasi pada alkanal/aldehid
Reaksi oksidasi alkanal digunakan sebagai reaksi identifikasi antara alkanal/aldehid dengan alkanon/keton. Simak informasi lengkapnya di sini.Reaksi oksidasi alkanon/keton
Alkanon tidak dapat mereduksi oksidator lemah seperti larutan fehling dan larutan tollens. Sifat ini, digunakan untuk membedakan alkanon dari isomer fungsinya, yaitu alkanal/aldehid.Baca juga, Reaksi Identifikasi Aldehida/Alkana dan Keton/ Alkanon.
Reaksi oksidasi pada asam alkanoat
Reaksi oksidasi asam alkanoat hanya terjadi pada asam metanoat dan asam 1,2 etanadioat5. Reaksi polimerisasi
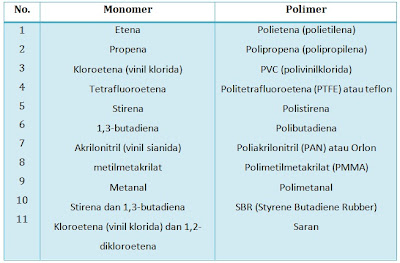
Reaksi polimerisasi melibatkan penggabungan molekul-molekul kecil yang disebut monomer menjadi suatu molekul rantai panjang atau yang disebut polimer. Anda dapat menyimak sifat-sifat polimer dengan mengklik di sini. Reaksi polimerisasi dapat dibedakan menjadi 2:Polimerisasi adisi: monomer-monomer bergabung membentuk suatu polimer
Monomer + monomer + monomer + . . . --> polimer
Beberapa monomer yang mengalami polimerisasi adisi dapat dilihat pada tabel berikut. Polimerisasi kondensasi: monomer-monomer bergabung membentuk polimer dengan melepas molekul kecil seperti H2O dan HCl
Monomer + monomer + monomer + . . . --> polimer + molekul kecil
Beberapa monomer yang mengalami polimerisasi kondensasi dapat dilihat pada tabel berikut Keterangan:
PET : suatu poliester yang secara teoritis dapat dibuat dari pencampuran asam flatat (asam karboksilat) dan etilen glikol (alkohol).
Nilon 6,6 : merupakan poliamida dengan gugus - CON - yang terbentuk dari polimerisasi 1,6-diaminoheksana dan asam 1,6-heksadioat.
Bakelit : polimer yang terbentuk dari polimerisasi metanal dan fenol.
Perspex : secara teoritis perspex terbentuk dari polimerisasi propanon (keton) dan metanal (aldehid) Download materinya, klik aja di sini
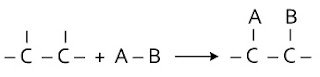


Komentar
Posting Komentar