Menghitung Perubahan Entalpi (∆H) reaksi Menggunakan Energi Ikatan
Energi Ikatan
Suatu reaksi kimia melibatkan pemutusan dan pembentukan ikatan kimia. Pemutusan ikatan kimia menyebabkan zat-zat pereaksi terpisah menjadi atom-atom penyusunnya. Atom-atom ini akan disusun ulang dan bergabung kembali membentuk ikatan kimia dalam zat-zat produk reaksinya. Pemutusan suatu ikatan memerlukan energi. Sebaliknya, suatu pembentukan ikatan akan melepaskan sejumlah energi. Energi yang terkait dengan pemutusan atau pembentukan ikatan kimia ini disebut energi ikatan.Energi ikatan dibedakan menjadi energi disosiasi untuk senyawa molekul, dan energi kisi untuk senyawa ion. Energi disosiasi (D) terkait dengan energi yang diperlukan untuk memutuskan ikatan senyawa molekul/kovalen. Sedangkan energi kisi terkait dengan energi yang dilepas untuk pembentukan ikatan senyawa ion. Pada bahasan berikutknya lebih difokuskan pada energi disosiasi.
Energi Ikatan untuk Menghitung Perubahan Entalpi Reaksi
Seperti yang dijelaskan di atas, reaksi kimia akan melibatkan energi untuk pemutusan ikatan antar atom pereaksi dan pembentukan ikatan antar atom produk reaksi. Selisih antara energi untuk pemutusan dan pembentukan ikatan ini adalah ∆H. Dapat dirumuskan sebagai berikut:∆Hreaksi = ∑ (Energi ikatan pereaksi) - ∑ (Energi ikatan produk reaksi)
1. Reaksi Peruraian H2O
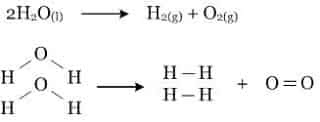
H2O dapat terurai menjadi gas H2 dan gas O2, dengan bantuan energi yang diperoleh dari arus listrik.Gambar 1. Reaksi peruraian Air
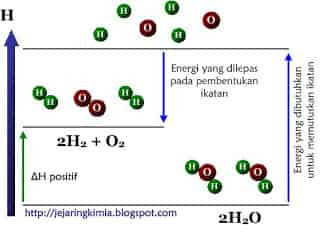
- Pemutusan 2 ikatan H - O menjadi atom-atom H dan O. energi yang diperlukan adalah sebesar ∑ (energi ikatan pereaksi)
- Pembentukan 2 ikatan H - H dan 1 ikatan O = O dari atom H dan O. energi yang dilepas adalah sebesar ∑ (energi ikatan produk reaksi).
Reaksi pembentukan CH4
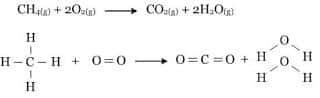
Reaksi pembakaran CH4 dengan O2, dihasilkan gas CO2 dan gas H2O. raeksinya adalah sebagai berikut:Gambar 3. Reaksi pembakaran gas metana
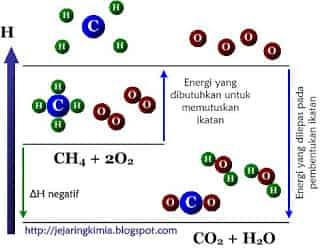
Gambar 4. Diagram tingkat energi pembakaran gas metana
Ada 2 tahapan dalam reaksi seperti yang ditunjukkan pada diagram entalpi pada gambar 4:
- Pemutusan 4 ikatan C - H dan ikatan rangkap O = O menjadi menjadi atom-atom C, H dan O. Energi yang diperlukan adalah sebesar ∑ (energi ikatan pereaksi)
- Pembentukan 2 ikatan C = O dan 2 ikatan H - O dari atom-atom C, H, dan O. Energi yang dilepas adalah sebesar ∑ (energi ikatan produk reaksi).
Secara umum, hubungan antara ∆H reaksi dengan ∑ (energi ikatan pereaksi) dan ∑ (energi ikatan produk reaksi) untuk reaksi endoterm dan reaksi eksterm dapat dilihat pada gambar berikut.
Gambar 5. Diagram tingkat energi reaksi endoterm
Gambar 6. Diagram tingkat energi reaksi eksoterm




Komentar
Posting Komentar