Faktor-faktor yang Mempengaruhi Kesetimbangan Reaksi Kimia
Materi Kimia – Ada tiga faktor yang mempengaruhi kesetimbangan, yaitu perubahan konsentrasi, perubahan tekanan (untuk gas), dan perubahan suhu. Pengaruh faktor-faktor tersebut terhadap kesetimbangan dapat diramalkan menggunakan Asas Le Chatelier yang diusulkan oleh Henry Le Chatelier pada tahun 1888.
Ada dua cara mengubah konsentrasi zat yaitu:
Pengenceran hanya akan menggeser kesetimbangan apabila:
Berdasarkan Asas Le Chatelier:
Jika suatu faktor luar mempengaruhi kesetimbangan, maka kesetimbangan akan bergeser untuk mengurangi pengaruh tersebut sampai diperoleh kesetimbangan yang baru.Berikut akan dijelaskan faktor-faktor yang mempengaruhi kesetimbangan.
1. Faktor Perubahan Konsentrasi
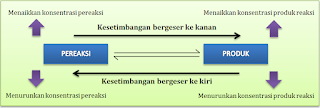
Berdasarkan Asas Le Chatelier, apabila konsentrasi pereaksi atau produk reaksi berubah, maka kesetimbangan akan bergerser untuk mengurangi pengaruh perubahan konsentrasi yang terjadi sampai diperoleh kesetimbangan yang baru.Ada dua cara mengubah konsentrasi zat yaitu:
a. Menaikkan/menurunkan konsentrasi pereaksi atau hasil reaksi
- Jika konsentrasi pereaksi dinaikkan, maka kesetimbangan akan bergeser ke kanan. Sebaliknya, jika konsentrasi pereaksi diturunkan, maka konsentrasi pereaksi akan bergeser ke kiri
- Jika konsentrasi produk reaksi dinaikkan, maka kesetimbangan akan bergeser ke kiri. Sebaliknya, jika konsentrasi produk reaksi diturunkan, maka kesetimbangan akan bergeser ke kanan.
b. Pengenceran
Pengenceran (penambahan pelarut cair misalnya air) akan menurunkan konsentrasi pereaksi zat-zat terlarut di dalamnya. Untuk reaksi kesetimbangan berikut:aA + bB <—> cC + dD
Pengenceran hanya akan menggeser kesetimbangan apabila:
Total mol pereaksi ≠ Total mol produk reaksi
Baca juga, Arti Tetapan Kesetimbangan.
2. Perubahan Tekanan
Pengaruh perubahan tekanan terhadap kesetimbangan reaksi berlaku hanya untuk sistem reaksi yang melibatkan gas. Berdasarkan Asas Le Chatelier, jika tekanan suatu sistem reaksi diubah, maka kesetimbangan akan bergeser untuk mengurangi pengaruh perubahan tekanan ini.- Jika tekanan bertambah, kesetimbangan akan bergeser ke arah dengan total mol lebih sedikit
- Jika tekanan berkurang, kesetimbangan akan bergeser ke arah dengan total mol lebih banyak.
Tekanan bertambah
Tekanan berkurang
3. Perubahan Suhu
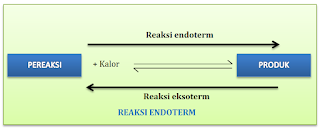
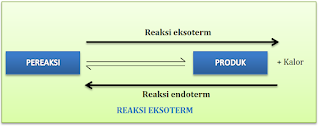
Perubahan suhu terkait dengan pelepasan atau penyerapan kalor. Pada reaksi kesetimbangan, apabila reaksi ke kanan menyerap kalor (reaksi endoterm), maka reaksi ke kiri akan melepas kalor (reaksi eksoterm). Demikian pula sebaliknya. Meski demikian, penulisan persamaan termokimianya akan merujuk pada reaksi ke kanan seperti pada skema berikut.Baca juga, Hubungan Tetapan Laju Reaksi dengan Kesetimbangan Kimia.
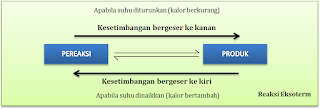
Berdasarkan Asas Le Chatelier:
- Apabila suhu reaksi dinaikkan, maka kesetimbangan akan bergeser ke arah reaksi yang menyerap kalor (reaksi edoterm)
- Apabila suhu reaksi diturunkan, maka kesetimbangan akan bergeser ke arah reaksi yang melepas kalor (reaksi eksoterm)






Komentar
Posting Komentar