Indikator Asam Basa
Karakteristik Asam Basa
Air murni tidak mempunyai rasa, bau, dan warna. Bila mengandung zat tertentu, air dapat terasa asam, pahit, asin dan sebagainya. Air yang mengandung zat lain dapat pula menjadi berwarna. Cairan yang berasa masam disebut larutan asam, yang terasa asin disebut larutan garam, sedangkan yang terasa licin dan pahit disebut larutan basa (Syukri, 1999:387).Asam dan basa sudah dikenal sejak jaman dahulu. Hal ini dapat dilihat dari nama mereka. Istilah asam berasal dari bahasa latin, acetum yang berarti cuka. Unsur pokok cuka adalah asam asetat CH3COOH. Istilah alkali diambil dari bahasa arab untuk abu. Diketahui bahwa hasil reaksi antara asam dan basa (netralisasi) adalah garam (Petrucci, R. H. dan Suminar, 1987).
Menurut Arrhenius, asam adalah zat yang dalam air dapat melepaskan ion hidrogen (H+), sedangkan basa adalah zat yang dalam air dapat melepaskan hidroksida (OH-). Menurut teori Bronsted-Lowry, asam adalah donor proton (H+), sedangkan basa adalah akseptor proton. Menurut Lewis, asam adalah penerima/akseptor pasangan elektron, sedangkan basa adalah pemberi/donor pasangan elektron.
Sifat asam dan basa larutan tidak hanya terdapat dalam larutan air, tetapi juga dalam larutan lain seperti amoniak, eter, dan benzena. Akibatnya cukup sulit mengetahui sifat asam dan basa larutan yang sesungguhnya.
Baca juga, Tata Nama Senyawa Asam Basa
Pengertian Indikator Asam Basa
Sejak dahulu orang sudah mencoba untuk mengidentifikasi sifat larutan ini dengan berbagai cara dari yang sangat sederhana, hingga menggunakan alat khusus. Cara yang baik adalah menguji larutan tersebut dengan suatu indikator (Syukri, 1999:387). Menurut Oxtobi, D. W. dkk (1998) indikator adalah zat warna larut yang perubahan warnanya tampak jelas dalam rentang pH yang sempit. Jenis indikator yang khas adalah asam organik yang lemah yang mempunyai warna berbeda dari basa konyugasinya. Lakmus berubah dari merah menjadi biru bila bentuk asamnya diubah menjadi basa. Indikator yang baik mempunyai intensitas warna sedemikian rupa sehingga hanya beberapa tetes larutan indikator encer yang harus ditambahkan ke dalam larutan yang sedang diuji. Konsentrasi molekul indikator yang sangat rendah hampir tidak berpengaruh terhadap pH larutan. Perubahan warna indikator mencerminkan pengaruh asam dan basa lainnya yang terdapat dalam larutan.Untuk menentukan suatu larutan termasuk asam, basa atau garam, dapat digunakan indikator asam basa. Indikator asam basa adalah petunjuk tentang derajat keasaman suatu larutan berdasarkan perubahan warna indikator akibat perubahan pH larutan. Indikator asam basa biasanya merupakan asam atau basa organik lemah. Senyawa indikator yang tak terdisosiasi akan mempunyai warna berbeda dibanding dengan indikator yang terionisasi. Sebuah indikator asam basa tidak mengubah warna dari larutan murni asam ke murni basa pada konsentrasi ion hidrogen yang spesifik, melainkan hanya pada kisaran konsentrasi ion hidrogen. Kisaran ini merupakan suatu interval perubahan warna, yang disebut rentang/trayek pH.
1) Identifikasi larutan dengan larutan indikator
Untuk mengidentifikasi sifat asam basa larutan, selain menggunakan kertas lakmus kita juga dapat menggunakan larutan yang berfungsi sebagai larutan indikator. Larutan indikator adalah larutan kimia yang akan berubah warna dalam lingkungan tertentu. Karena sifatnya yang dapat berubah warna inilah, larutan indikator dapat digunakan sebagai alat identifikasi larutan asam dan basa.Identifikasi larutan di laboratorium dapat menggunakan empat jenis larutan indikator, yaitu larutan fenolftalein, metil merah, metil jingga, dan bromtimol biru. Larutan indikator ini tidak seperti indikator lakmus yang mudah penggunaannya. Warna-warna yang terjadi pada larutan indikator jika dimasukkan ke dalam larutan asam dan basa, agak sulit diingat. Sebagai contoh, larutan fenolftalein. Pada lingkungan asam, larutan fenolftalein tidak berwarna, di lingkungan basa berwarna merah, sedangkan di lingkungan netral tidak berwarna. Berarti, untuk membedakan apakah suatu larutan bersifat asam atau netral, tidak cukup hanya dengan menggunakan larutan fenolftalein.
Baca juga, Memperkirakaan pH Larutan yang tidak DikenalLarutan metil merah dapat membedakan antara larutan asam dengan larutan netral. Larutan asam yang ditetesi metil merah akan tetap berwarna merah, sedangkan larutan netral berwarna kuning. Akan tetapi, metil merah juga akan menyebabkan larutan basa berwarna kuning, Berarti, untuk mengetahui apakah suatu larutan bersifat basa atau netral kita tidak dapat menggunakan metil merah. Untuk lebih jelasnya, perhatikan tabel warna larutan berikut ini.
Warna Larutan Indikator pada Lingkungan Asam, Basa, dan Netral
1. Indikator Fenolftalein
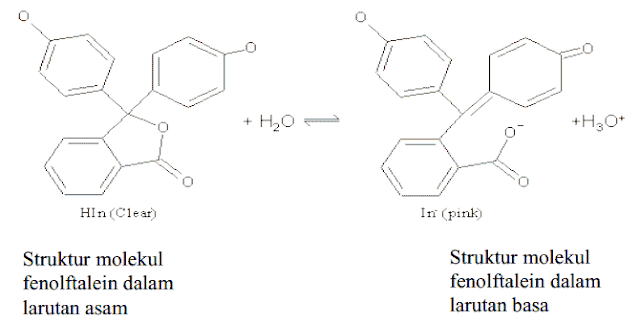
Fenolftalein adalah indikator titrasi yang lain yang sering digunakan, dan fenolftalein ini merupakan bentuk asam lemah yang lain. Perubahan warna pada fenolftalein karena perubahan pada struktur molekulnya. Dalam larutan asam, fenolftalein berada dalam bentuk molekul HIn-nya. Struktur ini berisi lima cincin yang terikat. Dalam larutan basa, struktur In- menjadi terbuka dan datar. Hal inimenyebabkan elektron lebih bebas, dan spektrum absorpsi molekulnya memancarkan warna merah. Hal inilah yang menyebabkan perubahan warna pada indikator fenolftalein.
Reaksi kesetimbangan yang terjadi pada fenolftalein adalah sebagai berikut:
H-phph(aq) < ---- > H+(aq) + phph-(aq)
Penambahan ion hidrogen berlebih menggeser posisi kesetimbangan ke arah kiri, dan mengubah indikator menjadi tak berwarna. Penambahan ion hidroksida menghilangkan ion hidrogen dari kesetimbangan yang mengarah ke kanan untuk menggantikannya – mengubah indikator menjadi merah muda.
2. Indikator Metil jingga
Metil jingga adalah salah satu indikator yang banyak digunakan dalam titrasi. Pada larutan yang bersifat basa, metil jingga berwarna kuning. Kesetimbangan yang terjadi pada metil jingga adalah:H-Meor(aq) < ---- > H+(aq) + Meor-(aq)
Pada metil jingga, campuran merah dan kuning menghasilkan warna jingga terjadi pada pH 3,7 hingga mendekati netral.
3. Indikator Metil merah
Pada larutan asam : merah;Pada larutan basa : kuning;
Netral : kuning
4. Indikator Bromtimol biru
Pada larutan asam : Kuning;
Pada larutan basa : Biru;
Netral : Biru agak kuning
Berbagai jenis Indikator
Perubahan warna (dari pH rendah ke pH tinggi) | ||
2) Identifikasi larutan dengan kertas lakmus
Sifat asam atau basa suatu larutan dapat juga diidentifikasi menggunakan kertas lakmus.Lakmus merupakan indikator asam basa yang sering digunakan, sifatnya asam lemah. Lakmus berasal dari kata litmus yaitu sejenis tanaman yang dapat menghasilkan warna jika ada asam atau basa. Lakmus memiliki molekul yang sangat rumit, biasa disederhanakan menjadi HLit. "H" adalah proton yang dapat diberikan kepada yang lain. "Lit" adalah molekul asam lemah.
Ada dua jenis kertas lakmus yaitu:
- kertas lakmus warna biru. Di dalam larutan asam, warna kertas berubah menjadi merah, sedangkan di dalam larutan netral atau basa, warna kertas tidak berubah (tetap biru)
- kertas lakmus warna merah. Di dalam larutan basa, warna kertas berubah menjadi biru, sedangkan di dalam larutan netral atau asam, warna kertas tidak berubah (tetap merah) (Johari, J, M, C, dan Rachmawati, M, 2004:162).
Hlit(aq) < ---- > H+ + Lit+
Lakmus yang tidak terionisasi (HLit) adalah merah, ketika terionisasi Lit- adalah biru. Berdasarkan Prinsip Le Chatelier, jika ditambahkan ion hidroksida atau beberapa ion hidrogen pada kesetimbangan ini terjadi pergeseran.
3) Identifikasi larutan dengan bahan alami
Bahan-bahan yang dapat dijadikan untuk mengidentifikasi sifat keasaman atau kebasaan suatu zat dinamakan indikator. Bahan-bahan indikator biasanya akan berubah warna ketika berada pada larutan tertentu. Ada banyak bahan di sekitar kita yang dapat berfungsi sebagai indikator, misalnya kulit buah manggis. Kulit buah manggis yang berwarna ungu akan berubah menjadi cokelat kemerahan jika berada dalam lingkungan asam. Dalam lingkungan basa, ekstrak kulit buah manggis akan berubah menjadi warna biru kehitaman. Ekstrak kembang sepatu yang berwarna merah jika ditambahkan ke larutan asam akan tetap merah. Jika ditambahkan ke larutan basa akan berubah warna menjadi kuning kehijauan (Sumarwan, dkk, 2007:67).REFERENSI
Johari, J, M, C dan Rachmawati. (2004). Kimia SMA untuk kelas XI. Jakarta : Erlangga
Oxtobi, D. R. (1998). Prinsip-prinsip Kimia Modern Jilid 1. Jakarta : Erlangga.
Petrucci, R. H. dan Suminar. (1987). Kimia Dasar (Prinsip dan terapan Modern Edisi keempat jilid 2). Jakarta : Erlangga.
Syukri. (1999). Kimia Dasar 2. Bandung : ITB.
Modul PKB Kimia
Lihat juga materi yang berhubungan denga indikator asam basa:
- PowerPoint Kumpulan Soal Asam Basan dan Stoikiometri Larutan
- Animasi Kimia Materi Asam Basa
- Prediksi Soal UN Kimia SMA 2011-2012



Komentar
Posting Komentar