Sel Elektrolisis Larutan Elektrolit
Sel Elektrolisis
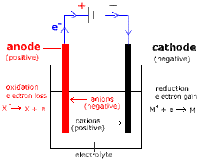
Sel eletrolisis merupakan sel eletrokimia di mana energi listrik digunakan untuk menghasilkan reaksi reduksi dan oksidasi (redoks) tidak spontan. Prinsip kerja sel eketrolisis adalah dengan menghubungkan kutub negatif dari sumber listrik ke katode, dan kutub positif ke anode. Kutub negatif dari sumber listrik akan mendorong elektron mengalir ke katode sehingga katode bermuatan negatif (-). Sementara kutub positif dari sumber listrik akan menarik elektron dari anode sehingga anode bermuatan positif (+). Katode yang bermuatan negatif akan menarik ion-ion positif dalam elektrolit, sehingga diperoleh setengah reaksi reduksi. Sedangkan anode yang bermuatan positif akan menarik ion-ion negatif dalam larutan elektrolit, sehingga diperoleh setengah reaksi oksidasi.Komponen Sel Elektrolisis
Secara umum sel elektrolisis terdiri dari:- Sumber listrik, menyuplai arus listrik searah (DC) contohnya baterai
- Katode, elektrode di mana reaksi reduksi terjadi. Karena elektron didorong oleh kutub negatif dari sumber listrik, maka katode menjadi bermuatan negatif
- Anode, elektrode di mana rekasi oksidasi terjadi. Karena elektron dari anode ditarik oleh kutub positif dari sumber listrik, maka anode bermuatan positif
- Elektrolit, zat yang dapat menghantar listrik yang akan diurai dalam sel elektrolisis
Baca juga, Faktor-faktor yang Mempengaruhi Korosi Logam
Ketentuan Elektrolisis pada Larutan Elektrolit
Sel elektrolisis pada larutan elektrolit melibatkan reaksi yang lumayan kompleks karena adanya reaksi-reaksi bersaing antara reaksi reduksi oksidasi (redoks) elektrolit dan reaksi reduksi oksidasi (redoks) pelarut air.Reaksi bersaing di katode:
- Reaksi reduksi kation
- Reaksi reduksi air: 2H2O(l) + 2e --> H2(g) + 2OH-(aq)
- Reaksi reduksi H+ (larutan elektrolit asam): 2H+(aq) + 2e --> H2(g)
Reaksi bersaing di anode:
- Reaksi oksiadsi anion
- Reaksi oksidasi air: 2H2O(l) --> O2(g) + 4H+(aq) + 4e
Reaksi reduksi di katode
Perhatikan kereaktifan logam pada deret volta berikut ini.- Ion positif dari logam-logam di sebelah kanan hidrogen pada deret volta akan tereduksi dan #2 mengendap pada katode
- Ion positif dari logam-logam di sebelah kiri hidrogen pada deret volta tidak akan tereduksi (kecuali untuk Fe, Ni, Sn, dan Pb). Hal ini disebabkan ion H+ dari H2O lebih mudah tereduksi dibandingkan ion positif dari logam di sebelah kiri H melalui reaksi reduksi air berikut ini:
2H2O(l) + 2e --> H2(g) + 2OH-(aq)
- Jika larutan elektrolit berupa asam, maka ion H+ dari asam yang akan tereduksi, dan bukan ion H+ dari H2O, seperti reaksi berikut ini:
2H+(aq) + 2e --> H2(g)
Reaksi oksidasi di anode
Jika anode tidak inert, makan logam anode akan teroksidasiJika anode inert, maka:
- Ion negatif yang tidak mengandung oksigen seperti Cl-, Br-, dan I- akan teroksidasi, seperti contoh reaksi berikut ini:
2Cl-(aq) --> Cl2(g) + 2e
- Ion negatif yang mengandung oksigen seperti SO42-, NO3-, dan PO43- tidak akan teroksidasi. Tetapi yang akan teroksidasi adalah Ion O2- dari H2O seperti reaksi berikut:
2H2O(l) --> O2(g) + 4H+(aq) + 4e
Contoh Reaksi Reduksi dan Oksidasi pada Sel Elektrolisis Elektrolit Larutan
Larutan NaCl dengan elektrode inert
Na terletak di sebelah kiri hidrogen pada deret volta sehingga Na+ tidak tereduksi. Maka, ion H+ dari H2O yang akan tereduksi Cl- adalah ion negatif yang tidak mengandung atom oksigen, maka ion Cl- akan teroksidasi. Jadi, ion OH- dari H2O tidak akan teroksidasi.Reaksi sel elektrolisis:
Katode: 2H2O(l) + 2e --> H2(g) + 2OH-(aq)
Anode: 2Cl-(aq) --> Cl2(g) + 2e
-----------------------------------------------------
Sel: 2Cl-(aq) + 2H2O(l) --> 2OH-(aq) + H2(g) + Cl2(g)
Reaksi sel elektrolisis keseluruhan:
2NaCl(aq) + 2H2O(l) --> 2NaOH(aq) + H2(g) + Cl2(g)
Larutan Na2SO4 dengan elektrode inert
Na terletak di sebelah kiri hidrogen pada deret volta sehingga Na+ tidak tereduksi. Jadi, ion H+ dari H2O yang akan tereduksi SO42- adalah ion negatif yang mengandung oksigen, jadi tidak akan teroksidasi. Dengan demikian, ion OH- dari H2O akan teroksidasi.Reaksi sel elektrolisis:
Katode: 2H2O(l) + 2e --> H2(g) + 2OH-(aq) |x2
Anode: 2H2O(l) --> O2(g) + 4H+(aq) + 4e-----------------------------------------------------
Sel: 6H2O(l) --> 2H2(g) + O2(g) + 4OH-(aq) + 4H+(aq)
Reaksi sel elektrolisis keseluruhan:
2H2O(l) --> 2H2(g) + O2(g)
Sel Elektrolisis pada Elektrolit Lelehan
menyusul


Komentar
Posting Komentar